Jeyanthi Kunadhasan
Λίγοι άνθρωποι αντιλαμβάνονται ότι η αίτηση για Άδεια (Εξουσιοδότηση) Επείγουσας Χρήσης Χορήγησης (Emergency Use Authorization – EUA) του εμβολίου Pfizer-BioNTech/BNT 162b2 ικανοποιήθηκε επί τη βάσει δεδομένων αποτελεσματικότητας μόλις για 170 ασθενείς. Οι 162 που έλαβαν εικονικό (placebo) και οι 8 που τους χορηγήθηκε το εμβόλιο (εμβολιάσθηκαν με το κανονικό εμβόλιο) αποτέλεσαν τη βάση για τους ισχυρισμούς περί 95% αποτελεσματικότητας του σκευάσματος.
Δεν έχει γίνει πολύ κουβέντα για αυτούς τους ασθενείς. Από πού κατάγονταν; Μπορούμε να έχουμε ένα κατά προσέγγιση χρονοδιάγραμμα σχετικά με το πότε έγινε η επιλογή τους για τη δοκιμή;
Στην κλινική δοκιμή της Pfizer-BioNTech (1) ορίστηκε ως endpoint, (δηλαδή ως έκβαση-στόχος) ή καταληκτικό σημείο endpoint= τελικό/ καταληκτικό σημείο (κατάσταση που ενδιαφέρονται να προσδιορίσουν οι ερευνητές και μετά να αποδείξουν ότι το σκεύασμα την βελτιώνει) η μόλυνση με Covid τουλάχιστον 7 μέρες μετά τη 2η δόση. Η αποτελεσματικότητα του εμβολίου μετρήθηκε υπολογίζοντας την πιθανότητα μόλυνσης μεταξύ εμβολιασμένων και μη εμβολιασμένων και προσδιορίζοντας τη μείωση στο ποσοστό της πιθανότητας μόλυνσης στους εμβολιασμένους σε σύγκριση με τους μη εμβολιασμένους (2).
Οι 170 ασθενείς βρέθηκαν βαθιά θαμμένοι μέσα σε εκατοντάδες χιλιάδες σελίδες, που μπορούσαν να γίνουν διαθέσιμες μόνο κατόπιν δικαστικής εντολής.
Σε μια μελέτη (3) που δημοσιεύσαμε στο dailyclout.io, οι συν-συγγραφείς μου και γω περιγράφουμε με λεπτομέρειες πώς τους βρήκαμε. Επίσης, διασταυρώσαμε τη λίστα ασθενών που βρήκαμε με δημοσίως διαθέσιμα δημογραφικά δεδομένα και υπήρξε απόλυτη ταύτιση και εξακρίβωση της εγκυρότητας των στοιχείων. Είμαστε πεπεισμένοι ότι, ως τέτοια, η λίστα μας με τους 170 ασθενείς, η οποία διατίθεται σε κοινή θέα στο άρθρο μας με τη μορφή λογιστικού φύλλου του Excel, περιλαμβάνει πράγματι τους 170 συμμετέχοντες στη δοκιμή που αποτέλεσαν τη βάση του ισχυρισμού περί «αποτελεσματικότητας» στο γνωστό επαναλαμβανόμενο ρητό περί «ασφάλειας και αποτελεσματικότητας».
Σύμφωνα με το πρωτόκολλο της δοκιμής, μια σοβαρή παρέκκλιση από αυτό στον αξιολογούμενο για την αποτελεσματικότητα πληθυσμό θα απέκλειε έναν συμμετέχοντα από την τελική ανάλυση. Αυτό φυσικά έχει νόημα, διότι γενικά εάν επρόκειτο ένα σκεύασμα να ανακηρυχθεί ως αποτελεσματικό, θα έπρεπε αυτό να γίνει στη βάση ενός πληθυσμού που θα είχε τηρήσει απαρέγκλιτα όλο το πρωτόκολλο της δοκιμής και δεν θα είχε κανένα από τα οριζόμενα στο πρωτόκολλο συμβάντα που θα ήταν ικανά να οδηγήσουν σε αποκλεισμό κάποιους συμμετέχοντες.
Τι λοιπόν βρήκαμε στον πληθυσμό των 170 ασθενών της δοκιμής;
Ένας από τους 170 δεν έλαβε την κατάλληλη δόση του υπό εξέταση σκευάσματος, ενώ κάποιος άλλος έλαβε στο αίμα του το σκεύασμα μέσα σε διάστημα 60 ημερών, κάτι που αποτελεί σοβαρή παρέκκλιση από το πρωτόκολλο. Δυο άλλοι αποσύρθηκαν από τη δοκιμή πριν την ημερομηνία έκδοσης της Άδειας Επείγουσας Χρήσης (EUA), αλλά ακόμη περιλαμβάνονταν στη λίστα των 170 που χρησιμοποιήθηκε στην ανάλυση (ένας από αυτούς ήταν δυσαρεστημένος από τον τρόπο με τον οποίο τους μεταχειρίζονταν στη μελέτη).
Παρατηρήσαμε επίσης πως το μεσοδιάστημα των δόσεων (που αναφερόταν στο πρωτόκολλο να είναι 21 ημέρες, με επιτρεπτή ανοχή 2 ημέρες πριν και μετά, δηλαδή μεσοδιάστημα 19-23 ημερών μεταξύ της 1ης και 2ης δόσης) όλως περιέργως επεκτάθηκε στις 19-42 ημέρες. Στη μελέτη μας (4) αποδεικνύουμε πώς τουλάχιστον 1410 ασθενείς που υπό άλλες συνθήκες θα θεωρούνταν παρεκκλίσεις από το πρωτόκολλο για αποτυχία λήψης του σκευάσματος μέσα στο μεσοδιάστημα δόσεων των 19-23 ημερών, θα μπορούσαν να συμπεριληφθούν σε μια τελική ανάλυση εάν αυτό επεκτεινόταν στις 10-42 ημέρες. Και επίσης, και ακόμη πιο αξιοσημείωτα, συμπεριλήφθηκαν 5 τέτοιοι ασθενείς στους 170 που αποτέλεσαν τη βάση για την τελική ανάλυση.
Το Πλάνο Στατιστικής Ανάλυσης επέτρεπε αλλαγές στο πρωτόκολλο (5) όπου αυτό κρινόταν απαραίτητο, αλλά ανέφερε ότι σοβαρές τέτοιες αλλαγές θα έπρεπε να αποτυπωθούν σε μια επίσημη τροποποίηση του πρωτοκόλλου. Δεν υπήρξε ποτέ όμως τέτοια επίσημη πράξη τροποποίησης του πρωτοκόλλου σε καμιά από τις συνολικά 14 εκδόσεις του πρωτοκόλλου που να καθορίζει επισήμως ότι το μεσοδιάστημα δόσεων επεκτείνεται στις 19-42 ημέρες. Στην πραγματικότητα, η τροποποίηση νούμερο 5 του πρωτοκόλλου (με ημερομηνία 24 Ιουλίου 2020), που έγινε 3 ημέρες πριν την επίσημη έναρξη των τμημάτων της φάσης 2/3 της δοκιμής, ξεκάθαρα διατυπώνει ότι το μεσοδιάστημα μεταξύ των δόσεων ορίζεται στις 21 ημέρες.
Το ερώτημα που εγείρεται είναι γιατί θεωρήθηκε πρέπον να διευρυνθεί το μεσοδιάστημα δόσεων ενός νέου σκευάσματος και πού βρίσκονται τα κλινικά δεδομένα που υποστηρίζουν μια τέτοια κίνηση;
Άραγε δεν πρέπει να θεωρηθεί η διεύρυνση του μεσοδιαστήματος χορήγησης των δόσεων για ένα νέο σκεύασμα στην πρώτη του κλινική δοκιμή μια σοβαρή τροποποίηση;
Προηγούμενες φάσεις αυτής της δοκιμής χρησιμοποιήσαν ένα διάστημα μεταξύ δόσεων 21 ημερών (6). Με το να μην καθορίζεται στο πρωτόκολλο ένας σαφής αριθμός στις λέξεις «προκαθορισμένο παράθυρο» για το μεσοδιάστημα χορήγησης δόσεων, επετράπη μια ηθελημένη ασάφεια. Το παράθυρο (μεσοδιάστημα) των 19-42 ημερών εμφανίστηκε για πρώτη φορά στα έγγραφα (τεκμήρια) της Άδειας Επείγουσας Χρήσης (EUA). Αυτό θέτει υπό αμφισβήτηση το νόημα της λέξης «προ» στο πεδίο «προκαθορισμένο παράθυρο» που έμεινε ασυμπλήρωτο. Πότε ορίζεις ένα «προκαθορισμένο παράθυρο» όταν από ότι φαίνεται αυτό ορίζεται με σαφήνεια εκ των υστέρων; Και πάλι, αυτό εξηγείται με μεγαλύτερη λεπτομέρεια στο άρθρο μας.
Από πού προέρχονται αυτοί οι ασθενείς; Ένας άλλος ερευνητής δεδομένων είχε την ευγενή καλοσύνη να απεικονίσει τους 170 ασθενείς μας στις διάφορες τοποθεσίες διερεύνησης. Θα περίμενε κάποιος μια μεγαλύτερη συμμετοχή στους 170 από πιο πυκνοκατοικημένες περιοχές των Ηνωμένων Πολιτειών καθώς πρόκειται για μια ιδιαίτερα μεταδιδόμενη νόσο (και έτσι θα ελεγχόταν καλύτερα η αποτελεσματικότητα του σκευάσματος ως προς την μετάδοση). Η Αργεντινή συνέβαλε στους 170 ασθενείς με 36 περιστατικά.

Ο χάρτης παρατίθεται με την ευγενική παραχώρηση του openvaet.org
Βρήκαμε ακόμη 6 ζεύγη διαδοχικών αριθμών στη λίστα μας. Σε μια αληθώς τυχαιοποιημένη ελεγχόμενη δοκιμή, κάθε ασθενής πρέπει να έχει την ίδια πιθανότητα να φτάσει στο καταληκτικό σημείο (endpoint) της δοκιμής. Προκαλούμε μαθηματικούς να υπολογίσουν την πιθανότητα 6 ζεύγη διαδοχικών αριθμών να εμφανιστούν σε μια λίστα 170 αριθμών από έναν υποψήφιο πληθυσμό 37000 (τελικός πληθυσμός που πλήρωσε τις προϋποθέσεις για ανάλυση) σε ένα αληθινά τυχαίο δείγμα.

Από τότε που δημοσιεύσαμε το αρχικό άρθρο, έχουμε (στο μεταξύ) αναλύσει το ρυθμό συσσώρευσης του πληθυσμού των 170 σε σχέση με την καταληκτική ημερομηνία της 14ης Νοεμβρίου 2020. Πρόκειται για μια κατά προσέγγιση ανάλυση, καθώς η ημερομηνία της διάγνωσης δεν καταγράφηκε ομοιόμορφα. Σε μερικές περιπτώσεις, θεωρήσαμε την ημερομηνία λήψης του δείγματος (ρινικού επιχρίσματος) ως μεταβλητή που υποκαθιστά την (όχι καταγεγραμμένη) ημερομηνία διάγνωσης.
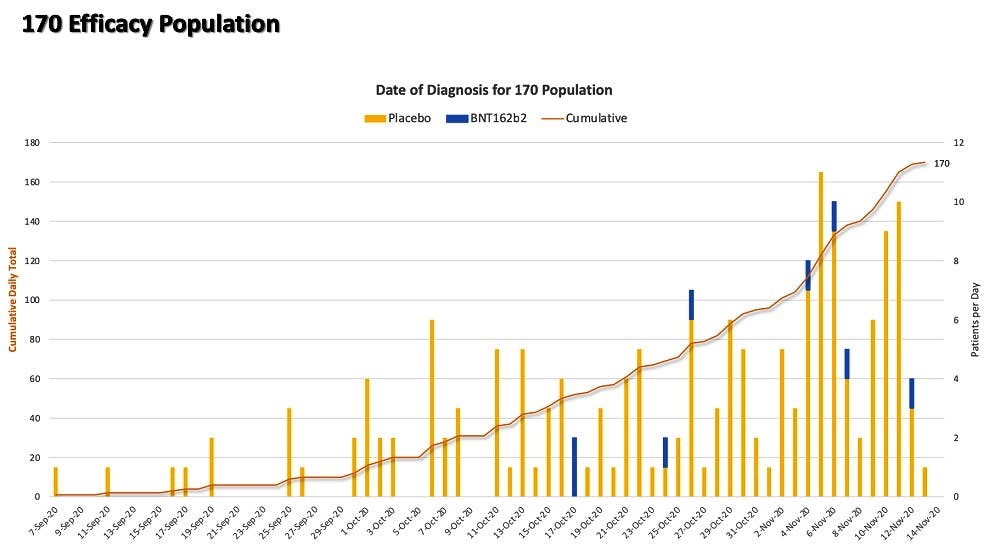
Το διάγραμμα παραχωρήθηκε από τους Ed Clark και Jeyanthi Kunadhasan
Προκειμένου να κατανοήσουμε το γενικό πλαίσιο για αυτό το θέμα, πρέπει να εξοικειωθούμε με το πλάνο ανάλυσης που η Pfizer καθόρισε στο πρωτόκολλο, δίνοντας ιδιαίτερη προσοχή στα όρια για την ανάλυση του μεσοδιαστήματος (μεταξύ δόσεων), καθώς και στα όρια της αποτελεσματικότητας και της ματαιότητας (futility) του σκευάσματος να πετύχει τους στόχους για τους οποίους δοκιμάζεται. Για παράδειγμα, εάν είχαν διαγνωστεί με Covid 54 εμβολιασμένοι ασθενείς από τους 164 ασθενείς μέσα στον εξεταζόμενο πληθυσμό, το σκεύασμα δεν θα ανακηρυσσόταν αποτελεσματικό για την παρεμπόδιση της μετάδοσης.
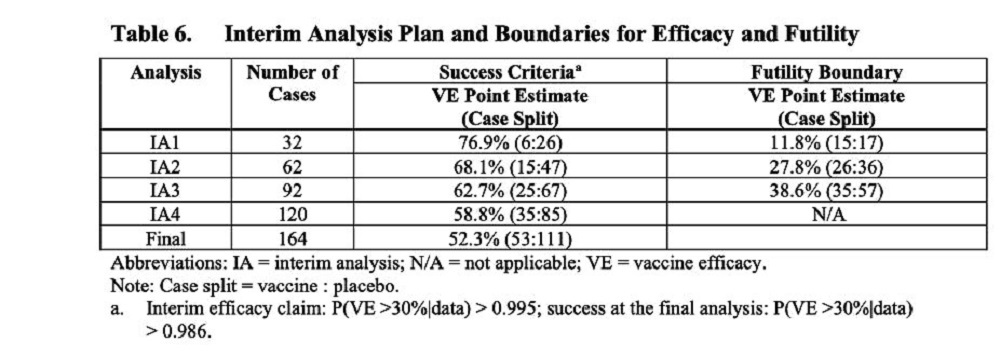

[Εάν δεν ανακηρυχθεί ούτε αποτελεσματικότητα ούτε ματαιότητα μετά από όλες τις ενδιάμεσες αναλύσεις (μεσοδιαστημάτων) – όπως καθορίζονται στο πρωτόκολλο και φαίνονται στον πίνακα 6 – διεξάγεται η τελική ανάλυση – πίνακας 8 – και θεωρείται ότι ο πρωταρχικός στόχος επιτυγχάνεται εάν βρεθούν 53 ή λιγότερα περιστατικά με Covid στην ομάδα εμβολιασμένων από το σύνολο των 164 πρώτων διαγνωσθέντων περιστατικών από την 7η μέρα και έπειτα από τη 2η δόση του προς διερεύνηση σκευάσματος].
Η ανάλυση της εγγραφής περιστατικών (accrual= ο αριθμός των ατόμων που ολοκλήρωσαν ή που βρίσκονται σε ενεργό διαδικασία να ολοκληρώσουν μία κλινική δοκιμή) που κάναμε, ζητάει επιτακτικά μια απάντηση στο ερώτημα πότε ακριβώς έγινε η ενδιάμεση ανάλυση (του μεσοδιαστήματος). Γιατί δεν ανακηρύχθηκε το σκεύασμα αποτελεσματικό όταν επιπλέον 62 περιστατικά που πληρούσαν τις προϋποθέσεις να συμπεριληφθούν στο καταληκτικό σημείο (endpoint) της δοκιμής θα είχαν συσσωρευθεί περίπου την τελευταία εβδομάδα του Οκτωβρίου 2020; Το όριο για τη ματαιότητα του σκευάσματος στο σημείο αυτό είχε περισσότερους από 15 εμβολιασμένους στον κατάλληλο για το καταληκτικό σημείο (endpoint) πληθυσμό.
Interim analysis= Η ανάλυση των δεδομένων που έχουν συλλεχθεί μέχρι στιγμής σε ενδιάμεσα χρονικά διαστήματα, πριν την ολοκλήρωση της συλλογής δεδομένων για μία κλινική δοκιμή.
Στην τεκμηρίωση της Άδειας Επείγουσας Χρήσης (EUA), αναφερόταν ως καταληκτική ημερομηνία δεδομένων για την πρώτη ανάλυση μεσοδιαστήματος για αποτελεσματικότητα η 4η Νοεμβρίου 2020, όταν συσσωρεύθηκε ένα σύνολο 94 διαγνωσθέντων περιστατικών COVID-19. Υπολογίσαμε ότι περίπου 112 περιστατικά θα είχαν συσσωρευθεί μέχρι και την 4η Νοεμβρίου 2020. Οι ελεγκτές μόνο είπαν δημόσια ότι δεν μπόρεσαν να κάνουν την πρώτη ενδιάμεση ανάλυση που είχε σχεδιαστεί για τη συσσώρευση 32 κατάλληλων περιστατικών. Δημόσια, επίσης, έγινε γνωστό ότι η πρώτη ενδιάμεση ανάλυση διεξήχθη την 4η Νοεμβρίου 2020. Δεν έγινε η ενδιάμεση ανάλυση νωρίτερα από αυτή την ημερομηνία; Γιατί;
Υπάρχει κάποια ιστορία πίσω από αυτούς που δεν κατάφεραν να συμπεριληφθούν στους 170; Η ομάδα ανάλυσης δεδομένων του dailyclout.io, ανέλυσε τους ασθενείς που τελικά αποκλείστηκαν από τη δοκιμή.
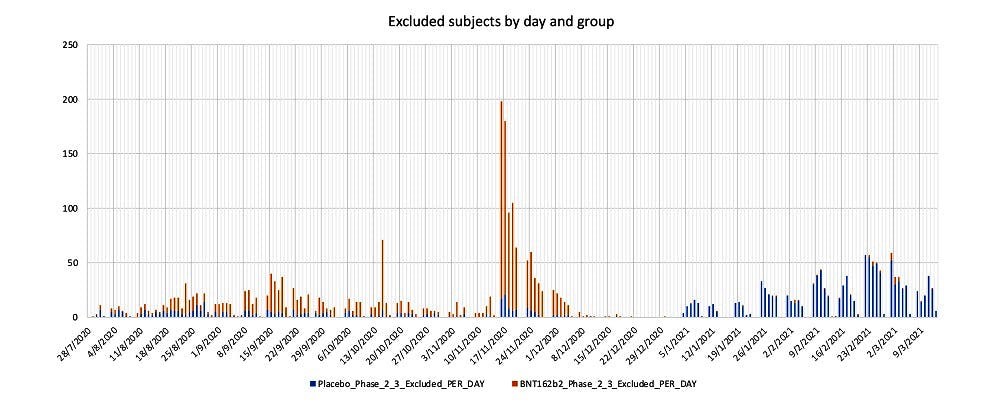
Το διάγραμμα παραχωρήθηκε από τον Jason Morphett
Συνδυάζοντας τα δύο, μαζί με κάποια σημαντικά γεγονότα στη χρονική αλληλουχία, μπορούμε να δούμε ότι οδεύοντας προς την έκδοση της Άδειας Επείγουσας Χρήσης, δυσανάλογα περισσότεροι εμβολιασμένοι ασθενείς αποκλείονταν από τη δοκιμή. Κατ’ ελάχιστον, χρειαζόμαστε να έχουμε – και πρέπει να μας παραχωρηθεί – πρόσβαση στο ιστορικό των ασθενών που αποκλείστηκαν. Η μεγαλύτερη κορύφωση που παρατηρούμε στο διάγραμμα δείχνει 181 (0,9%) από τους ασθενείς να αποκλείονται από το γκρουπ των εμβολιασμένων τη Δευτέρα 16 Νοεμβρίου 2020, ακριβώς μετά την καταληκτική ημερομηνία συλλογής δεδομένων της 14ης Νοεμβρίου 2020. Στο παρακάτω διάγραμμα, απεικονίζουμε επίσης τις απορρίψεις ασθενών από τη δοκιμή κατά τη χρονική σειρά της συσσώρευσης του πληθυσμού των 170.

Το διάγραμμα παρατίθεται με την ευγενική παραχώρηση των Ed Clark και Jeyanthi Kinadhasan
Γνώριζε ο Οργανισμός Θεραπευτικών Αγαθών (Therapeutic Goods Administration – TGA) (ο αντίστοιχος του FDA των ΗΠΑ για την Αυστραλία) τις ανωμαλίες που επισημάνθηκαν κατά τη συγκέντρωση των 170 ασθενών που αποτέλεσαν τη βάση του ισχυρισμού περί αποτελεσματικότητας του εμβολίου στην Άδεια Επείγουσας Χρήσης (EUA); Ως αναισθησιολόγος που τέθηκε σε διαθεσιμότητα εξαιτίας των εντολών υποχρεωτικού εμβολιασμού για Covid-19, φαίνεται ακόμη πιο γελοίο σε μένα ότι ο πληθυσμός των ασθενών βάσει του οποίου μου πήραν τη δουλειά, δεν έλαβε καν τη σωστή δόση του προς διερεύνηση σκευάσματος. Σύμφωνα με την ανάλυσή μας, τουλάχιστον 7 με 9 ασθενείς δεν έπρεπε καν να συμπεριληφθούν στην τελική ανάλυση αποτελεσματικότητας πάνω στην οποία βασίστηκε η έγκριση του σκευάσματος. Κάτι τέτοιο, θα έριχνε την ανάλυση κάτω από το τελικό όριο των 164 κατάλληλων για συμπερίληψη περιστατικών.
Η βάση πάνω στην οποία δόθηκε η Άδεια για Επείγουσα Χρήση (EUA) πρέπει να επανεξεταστεί. Πραγματικά είναι τόσοι πολλοί οι κανόνες που καταρρίφθηκαν σε αυτή την πανδημία, και σίγουρα μεταξύ αυτών δεν απουσιάζουν και αυτοί που αφορούν τη διεξαγωγή κλινικών δοκιμών…
1 Polack, F. P., Thomas, S. J., Kitchin, N., Absalon, J., Gurtman, A., Lockhart, S., . . . Gruber, W. C. (2020). Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. New England Journal of Medicine, 383(27), 2603–2615. https://doi.org/10.1056/nejmoa2034577
2 Principles of Epidemiology | Lesson 3 – Section 6. (n.d.). Retrieved from https://www.cdc.gov/csels/dsepd/ss1978/lesson3/section6.html
3 Kunadhasan, J., Clark, E., & Flowers, C. (2022, October 21). Report 42: Pfizer’s EUA Granted Based on Fewer Than 0.4% of Clinical Trial Participants. FDA Ignored Disqualifying Protocol Deviations to Grant EUA. Retrieved from https://dailyclout.io/report-41-the-170-clinical-trial-participants-who-changed-the-world-pfizer-ignored-protocol-deviations-to-obtain-emergency-use-authorization-for-its-covid-19-mrna-vaccine/
4 Kunadhasan, J., Clark, E., & Flowers, C. (2022, October 21). Report 42: Pfizer’s EUA Granted Based on Fewer Than 0.4% of Clinical Trial Participants. FDA Ignored Disqualifying Protocol Deviations to Grant EUA. Retrieved from https://dailyclout.io/report-41-the-170-clinical-trial-participants-who-changed-the-world-pfizer-ignored-protocol-deviations-to-obtain-emergency-use-authorization-for-its-covid-19-mrna-vaccine/
5 125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf. (n.d.). Retrieved from https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf
6 Mulligan, M. J., Lyke, K. E., Kitchin, N., Absalon, J., Gurtman, A., Lockhart, S., . . . Jansen, K. U. (2020). Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature, 586(7830), 589–593. https://doi.org/10.1038/s41586-020-2639-4
7 Lovelace, B., Jr. (2020, September 4). Pfizer CEO confirms late-stage coronavirus vaccine trial may have results in October. Retrieved from https://www.cnbc.com/2020/09/03/pfizer-ceo-confirms-coronavirus-vaccine-trial-may-have-results-in-october.html
8 Pfizer CEO pushes back against Trump claim on vaccine timing. (2020, October 2). Retrieved from https://apnews.com/article/election-2020-virus-outbreak-donald-trump-business-elections-bba3859d8465c309311bb911af33780f
9 Gruber, M. F. (2020, December 11). EUA Decision Memorandum. Retrieved from https://www.fda.gov/media/144416/download
20/12/22
